bat365正版唯一官网
Nature | 刘小云实验室与浙江大学朱永群/周艳实验室合作揭示病原菌催化新型磷酰基腺苷酸化修饰及其独特的致病机制
病原菌在与宿主长期相互斗争的过程中,进化出各种独特的蛋白质分泌系统,如III型和IV型分泌系统,转运多种毒性效应蛋白,作用于宿主细胞关键信号分子,拮抗宿主免疫防御和促进病原菌侵染。针对这些效应蛋白的功能解析不仅有助于阐明病原菌侵染宿主的分子机理,同时也能揭示新的细胞信号转导方式或生物学调控机制。刘小云课题组前期通过高精度质谱鉴定了一系列细菌毒力因子催化的新颖翻译后修饰,其中包括与罗招庆/邱家章实验室合作发现嗜肺军团菌SidE效应蛋白家族可催化不依赖于E1和E2的非经典泛素化修饰(Nature 2016,Cell Rep 2023);与邵峰院士实验室合作发现志贺氏菌通过全新ADP-riboxanation修饰抑制宿主细胞焦亡(Nature 2021,Cell Rep 2024);与朱永群/周艳实验室合作发现创伤弧菌介导的新型脂化修饰(Science 2017)和紫色色杆菌靶向泛素的苏氨酸ADP-核糖基化(Mol Cell 2020)。
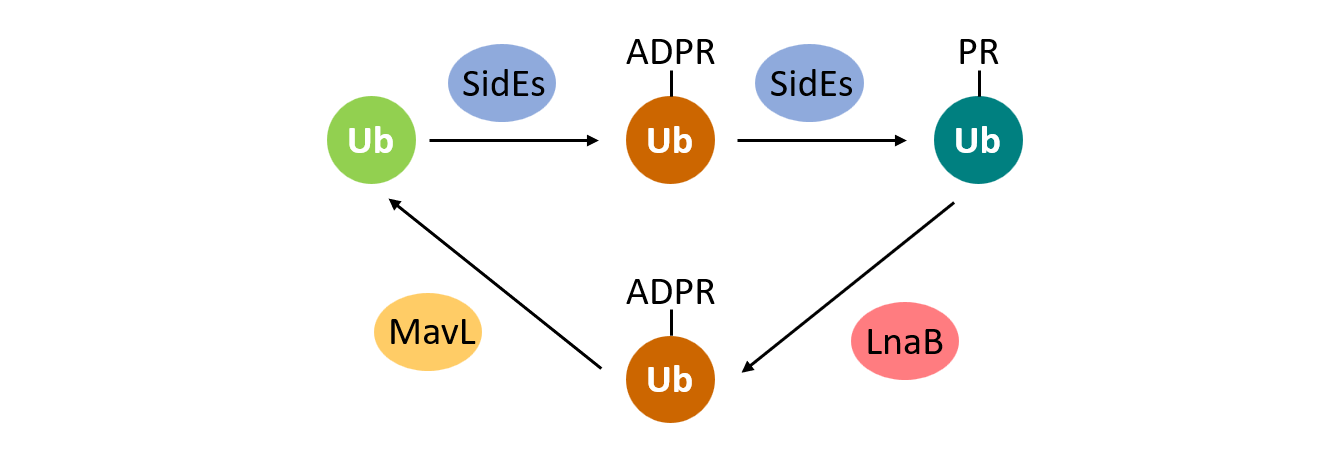
嗜肺军团菌是一种引起人非典型性肺炎的条件性致病菌,其通过IV型分泌系统分泌300多个效应蛋白到宿主细胞中。2016年罗招庆实验室首次发现该菌SidE家族蛋白催化一种不依赖E1和E2的非经典泛素化过程(Nature 2016)。在该酶促反应中,SidE首先催化泛素形成ADP-核糖基化的中间体(ADPR-Ub),随后其磷酸二酯酶结构域催化剪切,将ADPR-Ub的磷酸核糖化泛素(PR-Ub)转移连接到修饰底物的丝氨酸上。此外,效应蛋白DupA/B可进一步将磷酸核糖泛素化底物进行去泛素化(PNAS 2019)。然而,该非经典泛素化以及DupA/B的作用会导致PR-Ub在细胞中累积,产生细胞毒性,那么是否存在PR-Ub的去修饰途径呢?
2024年5月22日,浙江大学朱永群、周艳实验室与北京大学刘小云实验室合作,在Nature上在线发表了题为“Legionella effector LnaB is a phosphoryl-AMPylase that impairs phosphosignalling”的论文,发现了一类广泛存在于病原菌中的新型磷酰基单磷酸腺苷酸化酶效应蛋白,揭示了全新的磷酰基腺苷酸化修饰和调节磷酸化信号转导的方式。

文章发现嗜肺军团菌效应蛋白LnaB以ATP为配体,并以宿主肌动蛋白(actin)为激活剂,催化PR-Ub发生单磷酸腺苷酸化(AMPylation)修饰,反应生成的ADPR-Ub可进一步由效应蛋白MavL水解成为Ub。该过程实现了对非经典泛素化过程的逆转,从而保护了对嗜肺军团菌胞内生存和宿主细胞正常生理过程都至关重要的经典泛素化通路。
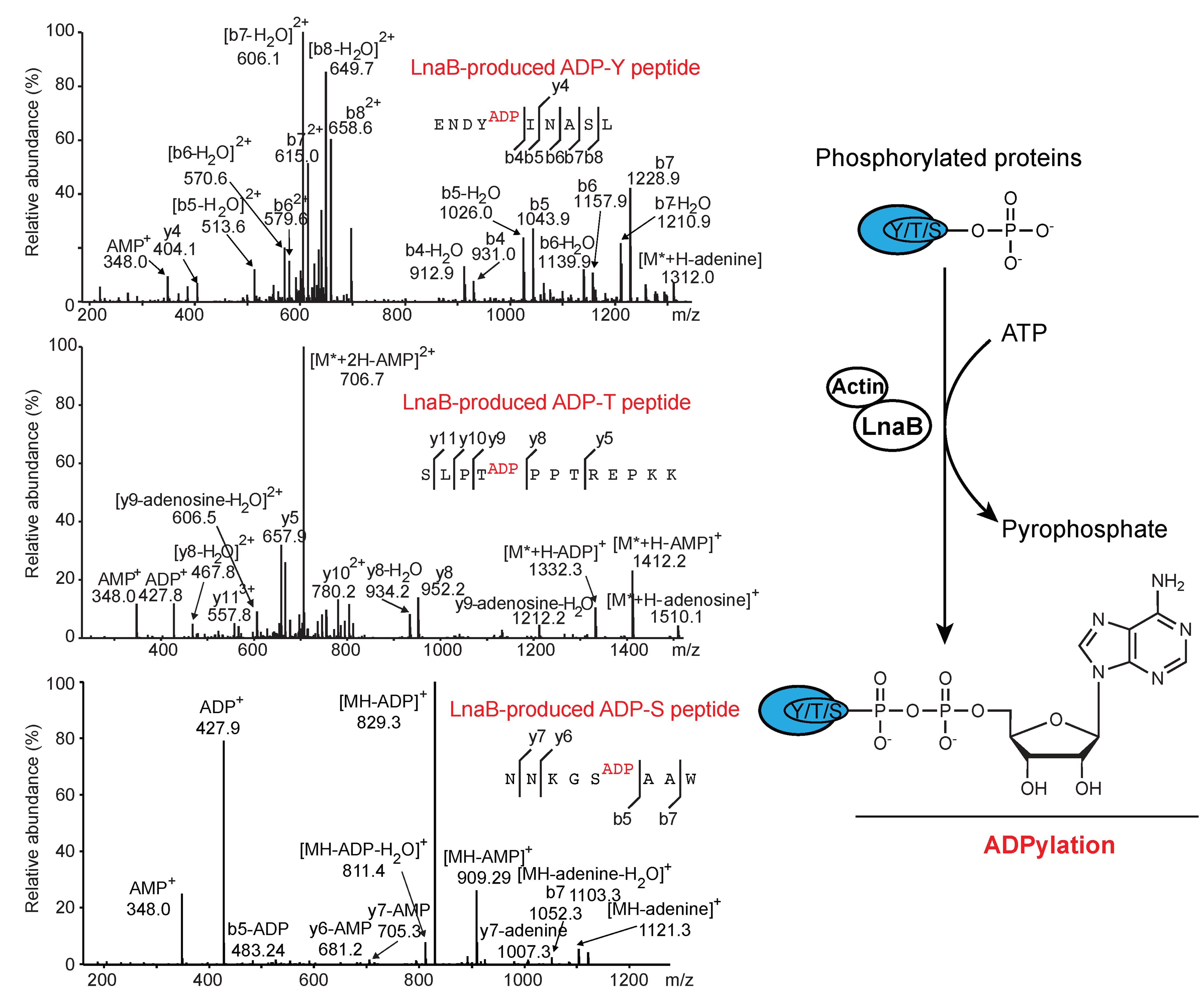
进一步利用质谱技术,研究团队发现LnaB可催化磷酸化修饰的多肽类底物发生磷酰基单磷酸腺苷酸化,从而产生特殊的ADPylation修饰。研究同时发现在感染过程中,LnaB可对宿主Src家族激酶上保守的磷酸化酪氨酸残基进行磷酰基单磷酸腺苷酸化修饰,从而抑制其下游磷酸化信号转导及相关免疫信号通路。
综上,这项研究以嗜肺军团菌效应蛋白LnaB为突破口,揭示了一种病原菌中保守的调节宿主信号通路的机制,为病原菌致病性和蛋白质翻译后修饰研究提供了新思路。浙江大学生命科学研究院/动物科学学院朱永群教授、生命科学学院周艳教授与bat365官网登录入口病原生物学系刘小云研究员是本文的共同通讯作者。该研究受到国家自然科学基金、国家重点研发计划等项目的资助。
原文链接:https://www.nature.com/articles/s41586-024-07573-z

