bat365正版唯一官网
吴聪颖团队报道mTORC1通路通过感知基底硬度 促进细胞增殖并抵抗失巢凋亡
2023年12月2日,bat365官网登录入口系统生物医学研究所吴聪颖课题组Advanced Science在线发表文章“mTORC1 mediates biphasic mechano-response to orchestrate adhesion-dependent cell growth and anoikis resistance”, 揭示了机械力信号通过黏着斑调控mTORC1通路的分子机制,并阐明了该机制在促进肿瘤细胞原位增殖和远端转移中的可能作用。

原位增殖和远端转移是肿瘤发生发展的两大关键步骤,也是抗肿瘤药物研发的关注重点。肿瘤微环境外基质分泌和交联增多、基质硬度增加从而促进癌细胞增殖。转移的癌细胞突破基底膜进入血管、淋巴管、腹腔等组织器官中。这些环境缺乏与细胞外基质的黏附,易诱发细胞的失巢凋亡,但部分癌细胞可抵抗失巢凋亡从而定殖于远端器官。癌细胞如何应对硬基底和失黏附这两种截然相反的机械力环境,实现增殖和抗凋亡的双面生存优势呢?
首先,使用Gpa级别的细胞培养皿和4 kPa的聚丙烯酰胺水凝胶分别作为硬基底和软基底,作者发现硬基底上细胞的增殖速率显著高于软基底,且该增殖优势依赖mTORC1通路。其次,作者观察到在硬基底上mTOR及其活化的下游底物phos-S6具有较强的黏着斑定位,而在软基底上这一特异性定位消失。接下来,通过siRNA文库筛选,作者明确了β1整合素在基底硬度活化mTORC1中的重要作用。通过进一步的研究,作者发现基质硬度对mTORC1活性的调控是通过影响mTOR蛋白的丰度实现的:硬基底通过黏着斑进行力学信号的传导,提高mTORC1通路的核心激酶mTOR的mRNA稳定性;而在软基底上,mTOR的mRNA稳定性降低。
进一步地,作者揭示了RNA转录后修饰在基底硬度活化mTORC1中的重要作用:硬基底降低了m6A去甲基化酶FTO的磷酸化水平,使其活性升高,擦除mTOR mRNA上的m6A修饰,从而提高转录本的稳定性;软基底抑制了FTO的活性,m6A修饰程度增加,使mTOR的转录本被降解。此外,通过免疫共沉淀与质谱技术联用,作者发现FTO活性的上游调节因子-糖原合成激酶GSK3β具有对基底硬度敏感的黏着斑定位:在硬基底上GSK3β发生磷酸化,黏着斑定位消失,解除对FTO活性的抑制,激活mTORC1通路;在软基底上,GSK3β发生活化抑制FTO,最终抑制mTORC1通路。
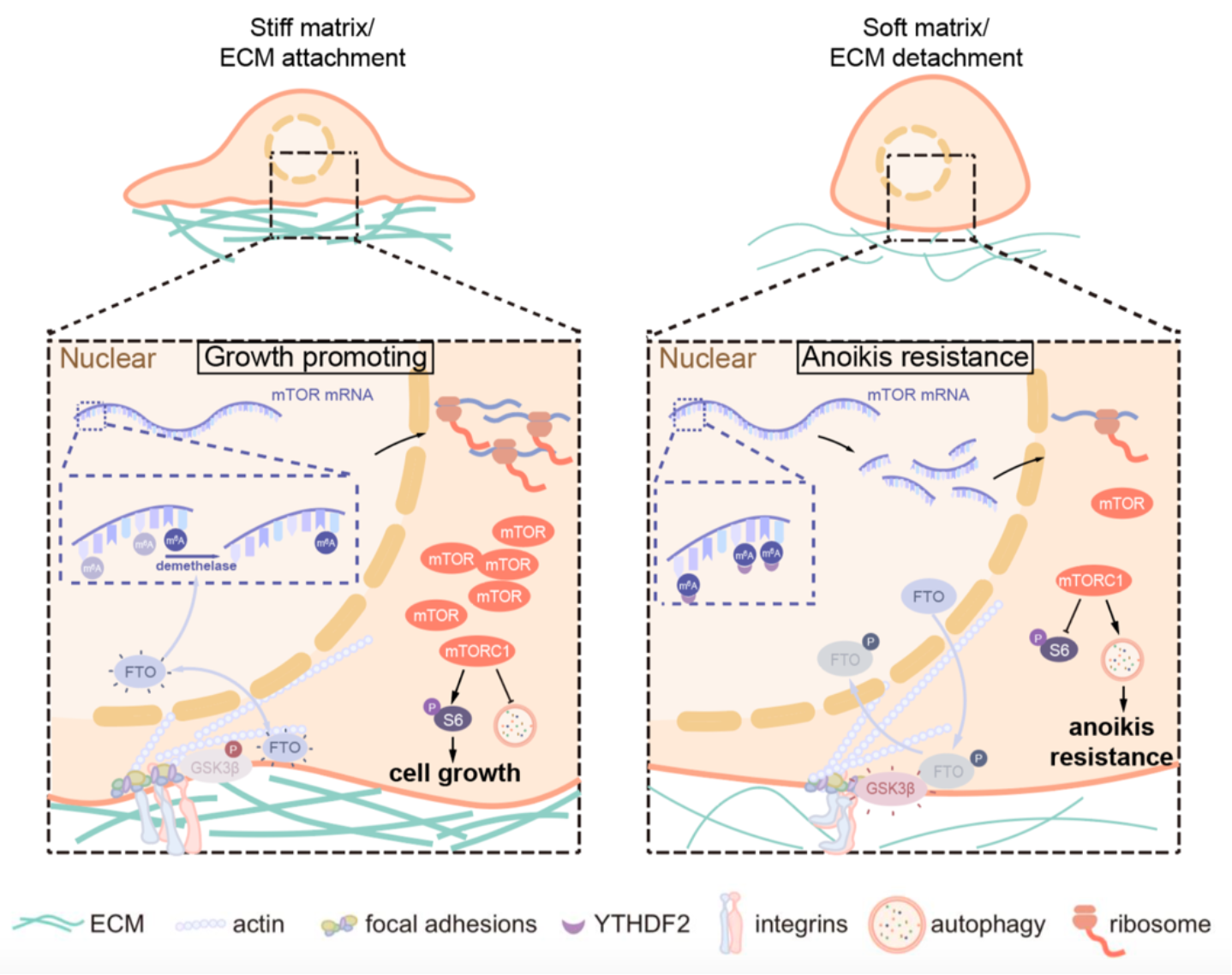
另一方面,作者也对肿瘤细胞抵抗失巢凋亡的机制进行了探索:当细胞与基底脱离时,所受到的力学刺激减弱,mTORC1活性受到抑制,细胞自噬水平上调,自噬可通过增加分解代谢为细胞提供物质和能量进而抵抗失巢凋亡。作者也在人乳腺导管原位癌和裸鼠恶性腹水模型中验证了该调控过程与分子机制。
综上所述,本研究发现了mTORC1是联系细胞机械力感应和细胞增殖、自噬的关键节点,发挥在硬基底促进肿瘤细胞生长,在软基底抵抗失巢凋亡的双重作用。该模型的提出为人类乳腺导管癌、上皮性卵巢癌等易发生远端转移浸润的病理过程提供了新的治疗方案和潜在药物靶点,具有高度的理论创新性和重要的临床意义。
bat365官网登录入口博士研究生张春蕾和博士后王源为论文的共同第一作者。该工作还受到bat365官网登录入口病理系苏静老师的支持与帮助。本研究受到国家重点研发计划和国家自然科学基金等经费的支持,得到了北京大学生命科学学院公共仪器中心和北京大学医药卫生分析中心的技术支持。
原文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202307206

