bat365正版唯一官网
Nat Commun | 柏林课题组与云彩红课题组合作揭示真菌几丁质合成酶的催化和抑制机制
2023年8月8日,bat365官网登录入口柏林研究员和云彩红教授合作团队在Nature Communications杂志在线发表了题为Structure, catalysis, chitin transport, and selective inhibition of chitin synthase的研究论文。该研究解析了真菌几丁质合成酶(Chs1)在不同底物或抑制剂结合状态下的一系列冷冻电镜结构,揭示了糖基供体和受体底物如何结合在活性位点,底物水解如何驱动自启动,转运几丁质的跨膜通道如何打开,以及肽基核苷类抑制剂如何抑制几丁质合成酶的分子机制,为理解几丁质合成酶的工作机制和抗真菌靶向抑制剂的研发提供了结构基础。

几丁质作为真菌细胞壁、甲壳类动物和昆虫外骨骼的主要成分,是地球上含量仅次于纤维素的第二大天然多糖,在这些生物的繁殖、生长或发育中起着重要作用。几丁质是β-(1,4)-连接N-乙酰氨基葡萄糖(GlcNAc)的长链聚合物,由位于质膜上的几丁质合成酶合成。几丁质合成酶以UDP活化的GlcNAc (UDP-GlcNAc)为糖供体,催化β(1→4)糖苷键的形成,同时将多糖产物通过跨膜通道运输到细胞外。由于几丁质在植物和脊椎动物中不存在,几丁质的生物合成被认为是研发杀菌剂、杀虫剂和抗真菌药物的重要靶点。例如,靶向几丁质合成酶的肽基核苷类抑制剂PolyoxinB (PolyB),在农林业中作为抗真菌剂被广泛用于对抗植物病原真菌和节肢动物害虫。另一种几丁质合成酶的肽基核苷类抑制剂Nikkomycin Z (NikkoZ),在哺乳动物对抗病原真菌方面显示出显著的临床疗效。几丁质合成酶的催化、产物转运以及抑制的分子机制都还不完全清楚。
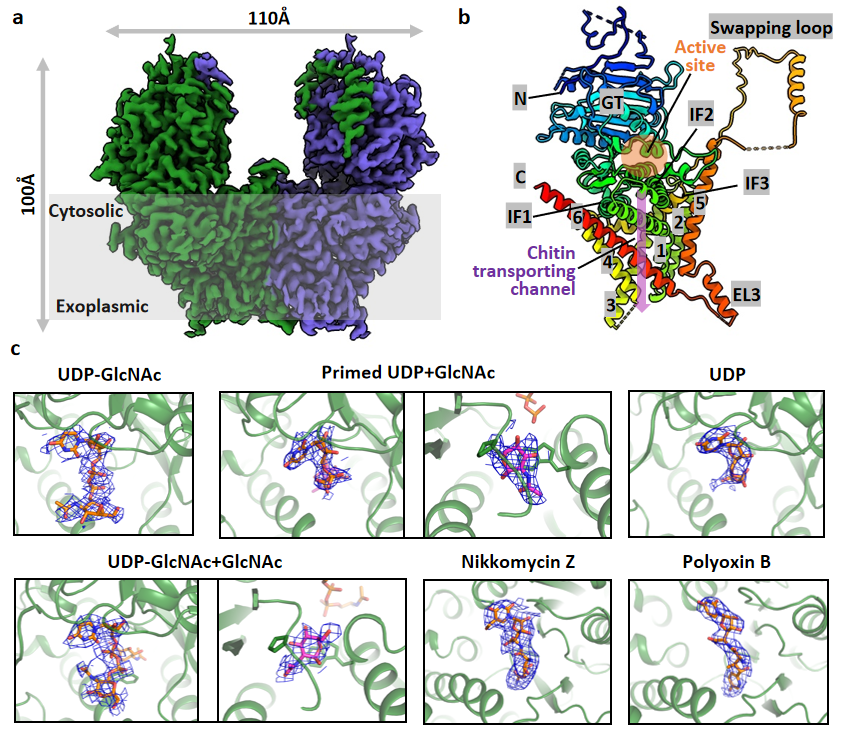
该研究首次清楚揭示了几丁质合成酶Chs1酶原的蛋白酶解激活是通过切除N端结构域所完成;并利用冷冻电镜技术解析了Chs1在apo、donor-loading(UDP-GlcNAc bound)、primed(UDP+GlcNAc bound)和donor+acceptor bound状态下的结构,提出了Chs1的工作模型。研究者发现Chs1以二聚体发挥功能,在apo状态下其活性位点开放,几丁质运输通道被胞质侧的Switch loop和跨膜螺旋TMH4封闭。随后,糖基供体UDP-GlcNAc主要通过UDP部分与Chs1结合(donor-loading状态),活性位点的关键氨基酸催化UDP-GlcNAc的水解。糖基供体的水解(primed状态)在受体结合位点生成几丁质链的第一个GlcNAc分子,其C4羟基指向活性位点;水解还引起Switch loop的翻转,从而打开了几丁质从活性位点到运输通道的大门;糖基转移酶结构域GTD则是向下构象移动,有助于将几丁质产物推向胞外转运。之后,UDP被释放,第二个供体分子结合在Chs1的活性位点,形成UDP- GlcNAc+GlcNAc结合状态。通过解析该状态结构,研究者进一步揭示糖基供体分子如何水解并与受体GlcNAc形成β(1→4)糖苷键生成双糖,并推测Chs1通过如此往复的供体结合和水解过程合成几丁质链。研究者还发现Chs1在底物合成过程中TMH4可向外移动打开几丁质运输通道,从而方便几丁质链跨膜转运到细胞外。此外,研究者还揭示了两种肽基核苷抑制剂(PolyoxinB和 Nikkomycin Z)通过占据供体和受体结合位点并阻断几丁质运输通道来抑制几丁质合成酶的功能。
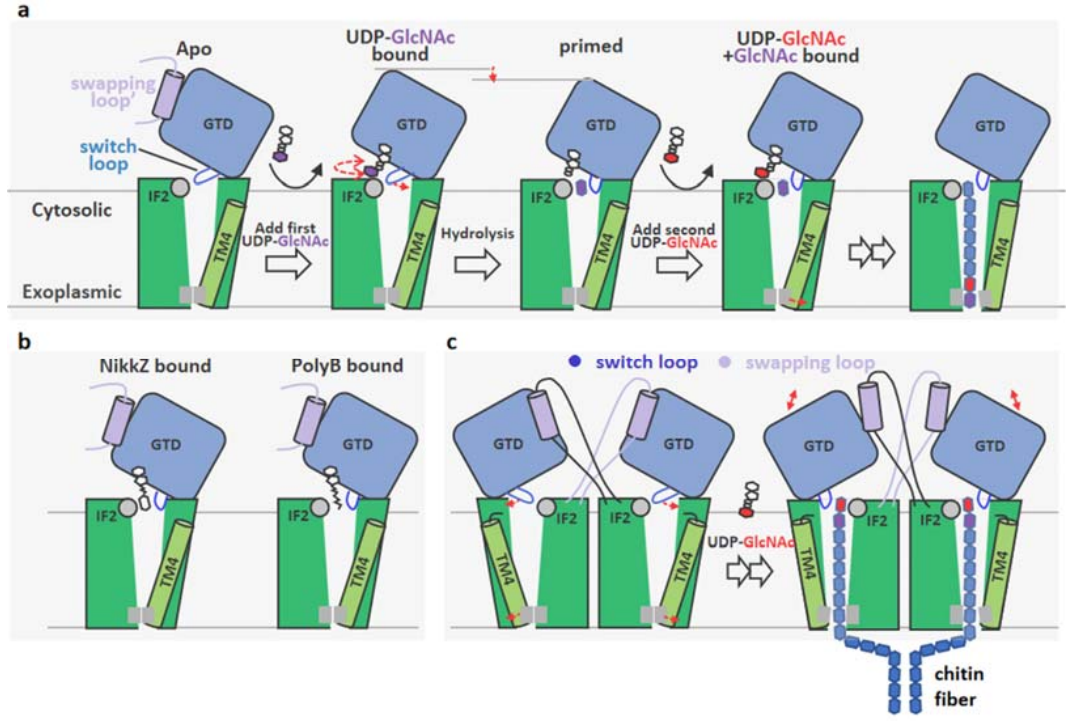
本研究为深入理解研究真菌几丁质合成酶的糖基转移酶活性和几丁质跨膜转运的分子机制以及肽基核苷几丁质合成酶抑制剂的抑制机制提供了新的见解。鉴于几丁质合成酶在病原真菌感染中的重要作用,这项工作为开发新的抗真菌小分子提供了理论依据平台。
bat365官网登录入口柏林研究员与云彩红教授是本研究论文的共同通讯作者。bat365官网登录入口陈丹丹博士和2017级八年制博士研究生王昭彬是本研究论文的共同第一作者。bat365官网登录入口2018级八年制博士研究生王乐瑄和赵鹏博士为本研究做出了重大贡献。柏林课题组主要利用冷冻电镜等生物化学与生物物理学方法研究真菌药物靶点的结构与功能以及基于结构的药物研发,在Nature、Nat. Struct. Mol. Biol.、Nat.Commun.和Proc. Nat. Acad. Sci. USA等期刊发表论文数十篇。本研究得到了国家自然科学基金、海外优秀青年基金、北京大学科研启动基金和国家基础发展项目等经费资助。
原文链接:https://www.nature.com/articles/s41467-023-40479-4

